
Jautājumi un atbildes
Par zāļu verifikācijas sistēmu un tās darbību
Kas ir zāļu verifikācijas sistēma?
Zāļu verifikācijas sistēma ir vienota zāļu drošības pārbaudes sistēma Eiropā, kuras mērķis ir novērst viltotu zāļu izplatīšanu un nonākšanu pie patērētājiem caur legāliem zāļu izplatīšanas kanāliem. Latvijas zāļu verifikācijas sistēmu ir izveidojusi un uztur Latvijas Zāļu verifikācijas organizācija (LZVO).
Kas nosaka šīs sistēmas ieviešanu?
Šīs prasības ir noteiktas ES Viltoto zāļu direktīvā (2011/62/ES) un Deleģētajā Regulā, kas nosaka detalizētus noteikumus par drošuma pazīmēm uz cilvēkiem paredzētu zāļu iepakojuma (ES 2016/161). Sistēma Latvijā un Eiropā darbojas kopš 2019. gada 9. februāra.
Kā sistēma ietekmē iedzīvotājus?
Iedzīvotāji var justies droši, iegādājoties zāles aptiekā vai saņemot pakalpojumus ar medikamentu izmantošanu veselības aprūpes iestādēs.
Kas uzrauga un kontrolē sistēmas darbību?
Latvijā ir trīs kompetentās iestādes: Veselības ministrija izstrādā veselības politiku un likumdošanu, tai skaitā normatīvo aktu bāzi zāļu apritei un zāļu verifikācijas sistēmas darbībai Latvijā; Zāļu valsts aģentūra reģistrē zāles, saskaņo drošuma pazīmju izvietošanu uz iepakojuma Latvijā reģistrētajām un paralēli importētajām zālēm un Veselības inspekcija uzrauga zāļu apriti, izmeklē viltojumu aizdomas un kontrolē zāļu izplatības kārtības ievērošanu, kā arī kopumā pārrauga zāļu verifikācijas procesu.
Kā šī sistēma darbojas?
Eiropas zāļu verifikācijas sistēma sastāv no Eiropas centrālā mezgla (EU hub) un nacionālajām zāļu verifikācijas sistēmām. EU hub zāļu ražotāji un paralēlie importētāji augšupielādē zāļu iepakojumu unikālo identifikatoru informāciju. Visām ES valstīm (tai skaitā EEZ valstīm) ir savas nacionālās zāļu verifikācijas sistēmas (izņemot Beļģiju un Luksemburgu, kur ir pārnacionālā zāļu verifikācijas sistēma), kurās nonāk ražotāju augšupielādētie dati, kas paredzēti attiecīgajam tirgum. Nacionālās zāļu verifikācijas sistēmas izmanto vietējie zāļu piegādes ķēdes dalībnieki, t.i., vairumtirgotāji, aptiekas, slimnīcu aptiekas un citas ārstniecības iestādes, kas tajā pārbauda (verificē) katru zāļu iepakojumu.
Kas ir unikālais identifikators?
Ar unikālu identifikatoru – drošuma pazīmi, ar kuras palīdzību iespējams identificēt un verificēt atsevišķa zāļu iepakojuma autentiskumu un šo identifikatoru dzēst, kad zāles tiek piegādātas iedzīvotājiem, katrs zāļu iepakojums tiek aprīkots jau ražošanas procesā.
Unikālais identifikators – konkrētajam zāļu iepakojumam unikāla skaitļu vai burtciparu virkne. Unikālais identifikators sastāv no šādiem datu elementiem:
• zāļu kods, kas dod iespēju identificēt vismaz ar unikālo identifikatoru aprīkoto zāļu nosaukumu, vispārpieņemto nosaukumu, zāļu formu, koncentrāciju, zāļu iepakojuma izmēru un veidu;
• partijas numurs;
• derīguma termiņš;
• seriālais numurs.
Ražotāji unikālo identifikatoru iekodē 2D kodā (divdimensiju svītrkods), kas ir mašīnlasāma datu matrica. Kodu skenē un salīdzina ar zāļu verifikācijas sistēmā glabātajiem unikālajiem identifikatoriem, lai pārbaudītu zāļu autentiskumu.
Kas ir seriālais numurs?
Seriālais numurs ir daļa no unikālā identifikatora, un ir unikāls katram zāļu iepakojumam.
Tas sastāv no nejaušināšanas algoritma ģenerētas skaitļu vai burtciparu virknes ar ne vairāk kā 20 rakstzīmēm. Varbūtībai, ka seriālo numuru iespējams uzminēt, jābūt pavisam niecīgai un jebkurā gadījumā zemākai nekā 1:10 000. Rakstzīmju virkne ir tāda, lai vismaz 1 gadu pēc minētā iepakojuma derīguma termiņa vai 5 gadus pēc attiecīgā iepakojuma laišanas tirdzniecībā vai izplatīšanā tā attiecīgajam zāļu iepakojumam būtu unikāla.
Par zāļu verifikācijas procesu
Vai tiek pārbaudītas visas zāles?
Tiek pārbaudītas visas recepšu zāles un bezrecepšu medikaments omeprazols. Pilns saraksts pieejams Eiropas Komisijas 2015. gada 2. oktobra Deleģētās Regulas (ES) 2016/161 I un II pielikumā: https://eur-lex.europa.eu/legal-content/LV/TXT/PDF/?uri=CELEX:32016R0161&from=CS
Kādas zāles nav jāpārbauda?
Verifikācijas sistēmā nav jāpārbauda bezrecepšu medikamenti, izņemot omperazolu, kā arī visi uztura bagātinātāji (piemēram, vitamīni u. tml.) un medicīnas preces. Atsevišķi izņēmumi ir arī recepšu medikamentiem, piemēram, dažādām gāzēm un šķīdumiem. Pilns saraksts ar izņēmumiem atrodams Deleģētās Regulas I pielikumā:https://eur-lex.europa.eu/legal-content/LV/TXT/PDF/?uri=CELEX:32016R0161&from=CS
Kas zāles pārbauda un kas – dzēš no sistēmas?
Sistēmā ir iespējamas divas pamata transakcijas – iepakojuma verifikācija jeb pārbaude un iepakojuma dzēšana no sistēmas. Visi sistēmas dalībnieki, izņemot gala lietotājus, zāļu iepakojumus tikai pārbauda pret datubāzi jeb verificē. Iepakojumu pārbauda un vienlaikus no sistēmas dzēš tikai gala lietotājs, iepakojumu pārdodot (aptieka) vai izlietojot (veselības aprūpes iestāde) pacientam.
Izņēmuma gadījumi, kad lieltirgotavas, saskaņā ar Ministru kabineta noteikumiem Nr. 416, drīkst verificēt un dzēst uz zāļu iepakojuma esošo unikālo identifikatoru Latvijas Zāļu verifikācijas sistēmā, ir: izplatot vakcīnas ģimenes ārsta praksēm, feldšerpunktiem un feldšeru–vecmāšu punktiem; izplatot zāles sociālās aprūpes institūcijām; izplatot zāles personām, kurām ir Zāļu valsts aģentūras izsniegta atļauja zāļu iegādei saskaņā ar Farmācijas likuma 48. panta pirmo daļu; izplatot zāles praktizējošiem veterinārārstiem un veterinārmedicīniskās aprūpes iestādēm; izplatot zāles Aizsardzības ministrijas Nacionālo bruņoto spēku ārstniecības iestādēm, kuras zāles iegādājas civilās aizsardzības un katastrofu pārvaldības vajadzībām.
Kādos gadījumos sistēma ģenerē trauksmes brīdinājumu?
Lielākā daļa trauksmes brīdinājumu ir tehniskas dabas, kas rodas vai nu ražotāju pusē (nepareizi ievadot datus par iepakojumu, partiju, derīguma termiņu vai tirgu) vai gala lietotāju pusē, izmantojot nepareizi konfigurētus skenerus vai sistēmas vai neievērojot verifikācijas noteikumus, piemēram, atkārtoti skenējot vienu iepakojumu. Tā ir izplatīta kļūme, ja zāļu iepakojums tiek dalīts.
Par verifikācijas sistēmas uzturēšanu un datu drošību
Kas finansē sistēmas ieviešanu un darbību?
Deleģētā Regula nosaka, ka lielākās izmaksas sedz zāļu ražotāji – viņi investē ražošanas līniju pilnveidē, lai katru zāļu iepakojumu varētu marķēt ar unikālo identifikatoru. Tāpat ražotāji maksā par Eiropas zāļu verifikācijas sistēmas un arī nacionālo sistēmu uzturēšanu.
Kā tiek nodrošināta datu drošība?
Likumdošana stingri nosaka, ka sistēmā esošie dati pieder tikai tam subjektam, kas tos ģenerē. Piegādes ķēdes dalībniekiem nav piekļuves citu dalībnieku izveidotajiem datiem. Sistēma neglabā personas datus.
Kas var pieslēgties sistēmai?
Latvijas zāļu verifikācijas sistēmai (LZVS) drīkst piekļūt un lietot tikai tādi gala lietotāja pārstāvji, kuru identitāte, loma un tiesības piekļuvei LZVS ir pārbaudītas un akceptētas.
Gala lietotājs drīkst pieslēgties un izmantot LZVS tikai, lai verificētu un / vai dzēstu zāļu unikālo identifikatoru tikai tiem produktiem, kas atrodas tā fiziskā kontrolē.
Vai sistēmu var izmantot citiem mērķiem, piemēram, zāļu iepakojumu izsekošanai vai zāļu trūkuma novēršanai?
Nē, šobrīd verifikācijas sistēmā uzkrāto datu izmantošana citiem mērķiem kā tikai drošuma pārbaudēm, nav paredzēta un atļauta.
Par verifikācijas sistēmas gala lietotājiem
Kam Latvijā ir jāpieslēdzas sistēmai un jāpārbauda zāles?
Zāļu verifikācijas pienākums Latvijā ir noteikts visām aptiekām (slēgta un atvērta tipa), zāļu lieltirgotavām, slimnīcām, veselības aprūpes iestādēm, kam ir zāļu iegādes atļauja, piemēram, poliklīnikām, veselības centriem un ārstu praksēm, tāpat arī zobārstniecības klīnikām un ārstu praksēm.
Kad unikālais identifikators jādzēš no sistēmas?
Personas, kam atļauts vai kas tiesīgas iedzīvotājiem piegādāt zāles, drošuma pazīmes verificē un unikālo identifikatoru dzēš brīdī, kad zāles tiek piegādātas iedzīvotājiem.
Veselības aprūpes iestādē strādājošas personas, kam atļauts vai kas tiesīgas iedzīvotājiem piegādāt zāles, šo verificēšanu un dzēšanu var veikt jebkurā laikā, kad zāles atrodas veselības aprūpes iestādes valdījumā, ja vien laikā no zāļu piegādes veselības aprūpes iestādei līdz to piegādei iedzīvotājiem zāles netiek pārdotas.
Cik gala lietotāju ir verifikācijas sistēmā Latvijā?
Gala lietotāju skaits pastāvīgi mainās, jo Latvijas Zāļu verifikācijas organizācija (LZVO) rūpējas, lai sistēmai būtu pievienoti tikai leģitīmi lietotāji. Pašlaik Latvijas zāļu verifikācijas sistēmai ir pieslēgušies aptuveni 1200 gala lietotāji.
Par gala lietotāju pienākumiem
Kādi ir gala lietotāju pienākumi?
Gala lietotājiem, uz ko attiecas verifikācijas pienākums, ir jānoslēdz līgums ar Latvijas Zāļu verifikācijas organizācija (LZVO) un jāpieslēdzas sistēmai. Gala lietotājam ir jāizvēlas savs IT pakalpojuma sniedzējs, kam ir izstrādāts risinājums, lai pieslēgtos Latvijas zāļu verifikācijas sistēmai (LZVS).
Gala lietotājam ir jānodrošina visa nepieciešamā tehnika, pakalpojumi, iekārtas un programmatūra, lai lietotu LZVS, ieskaitot attiecīgo datortehniku un interneta pieslēgumu. Gala lietotājs drīkst pieslēgties un izmantot LZVS, lai verificētu un / vai dzēstu zāļu unikālo identifikatoru tikai tiem produktiem, kas atrodas tā fiziskā kontrolē.
Ko darīt, ja sistēma nedarbojas?
Gadījumos, ja zāļu verificēšana nav iespējama tehnisku iemeslu dēļ, gala lietotājiem unikālais identifikators (iepakojuma unikālie dati) ir jāņem uzskaitē. Tehniskas problēmas ir interneta darbības pārtraukums, kādas IT sistēmas nepieejamība, elektrības padeves pārtraukums vai citas tehniskas problēmas gala lietotāja pusē vai Latvijas zāļu verifikācijas sistēmas pusē. Lietotājs koda autentiskumu verificē un identifikatoru dzēš tūlīt pēc tehnisko problēmu atrisināšanas.
Kad ir jādzēš unikālais identifikators dalītam iepakojumam?
Zāļu verifikācijas sistēma neko nemaina Latvijas noteikumos par zāļu iepakojumu dalīšanu. Zāļu iepakojuma unikālā identifikatora dzēšana ir jāveic, iepakojumu atverot pirmoreiz.
Lai noņemtu dalītos iepakojumus no savas uzskaites sistēmas, katram gala lietotājam ir jārīkojas atbilstoši savām iekšējām vadlīnijām un procedūrām.
Kā rīkoties, ja ir kļūdaini dzēsts iepakojums?
Ja gala lietotājs ir kļūdaini dzēsis iepakojumu no sistēmas, ir jāveic atgriešanas darbība, un to nepieciešams izdarīt 10 dienu laikā. Pēc 10 dienu termiņa beigām atgriešanas darbība būs nesekmīga, sistēmā norādot, ka ir radusies “L1-4” kļūda.
Par trauksmes brīdinājumu izmeklēšanu
Ko darīt, ja dzēšot iepakojumu ir saņemts trauksmes brīdinājums?
Šīs zāles nedrīkst pārdot vai izlietot pacientiem, tās līdz trauksmes brīdinājuma cēloņa atrisināšanai ir jāievieto karantīnā. Sistēmā tiek ģenerēts trauksmes brīdinājums, kuru jāizmeklē atbilstoši sistēmas lietotājam, pie kura tika ģenerēts trauksmes brīdinājums, un konkrētā zāļu iepakojuma ražotājam. Viltojuma aizdomu gadījumā izmeklēšanu veic atbildīgā valsts institūcija – Veselības inspekcija.
Kur ir aprakstīta trauksmes brīdinājumu izmeklēšana?
Eiropas Zāļu verifikācijas organizācija (EMVO) ir apstiprinājusi un publicējusi vadlīnijas “Labās prakses piemēri rīcībā ar trauksmes brīdinājumiem”, kas apraksta vispārīgos principus trauksmes brīdinājumu izmeklēšanai un informācijas apritei, kā arī definē visu procesā iesaistīto pušu – EMVO, nacionālo zāļu verifikācijas organizāciju, ražotāju un sistēmas gala lietotāju – pienākumus un tiesības trauksmes brīdinājumu apstrādes procesā. Vadlīnijas pieejamas (angļu valodā): https://emvo-medicines.eu/new/wp-content/uploads/Best-Practice-on-Alert-Handling.docx.pdf.
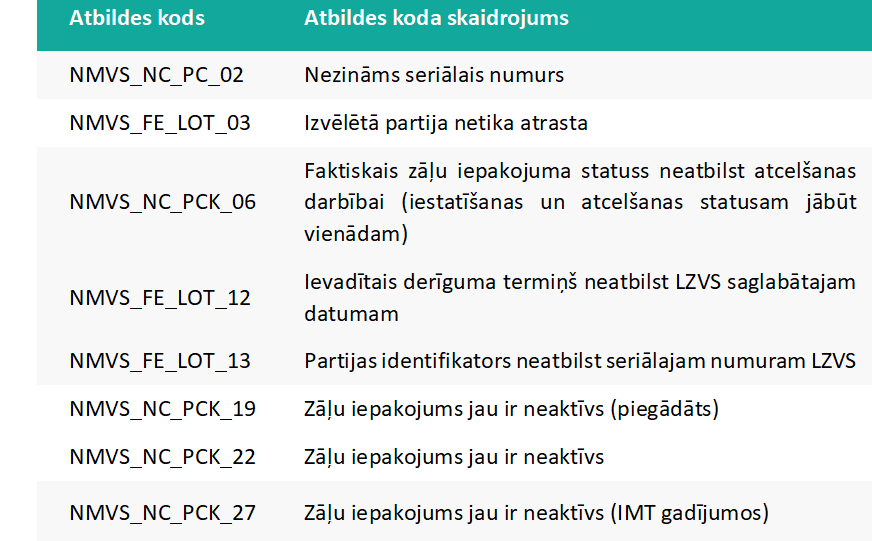
Trauksmes brīdinājumu kodu atšifrējums
Kāda ir gala lietotāja rīcība trauksmes brīdinājuma gadījumā?
Zāļu iepakojumu, kas ir radījis trauksmes brīdinājumu, nedrīkst pārdot vai izmantot pacientam. Brīdī, kad verifikācijas sistēma ģenerē trauksmes brīdinājumu, izmeklēšana ir jāuzsāk gan gala lietotājam, gan ražotājam. Gala lietotājs veic sekojošas darbības:
• zāļu iepakojums ir jāliek karantīnā līdz trauksmes brīdinājuma cēloņa atrisināšanai;
• jāpārliecinās, ka trauksmes brīdinājuma iemesls nav tehniska, procesuāla vai manuāla kļūda;
• ja kļūda nav identificēta gala lietotāja pusē, tad jāsāk trauksmes brīdinājuma izmeklēšana, sazinoties ar reģistrācijas apliecības īpašnieku (RAĪ);
• reģistrācijas apliecības īpašnieks, Latvijas Zāļu verifikācijas organizācija vai Veselības inspekcija var pieprasīt trauksmes brīdinājumu izraisījušā zāļu iepakojuma fotogrāfiju tālākai izmeklēšanai;
• jādokumentē trauksmes brīdinājums un tā izmeklēšana;
• nepieciešamības gadījumā var lūgt Latvijas Zāļu verifikācijas organizācijas un/ vai Veselības inspekcijas atbalstu.
Kāda ir reģistrācijas apliecības īpašnieka rīcība trauksmes brīdinājuma gadījumā?
Brīdī, kad verifikācijas sistēma ģenerē trauksmes brīdinājumu, izmeklēšana ir jāuzsāk gan gala lietotājam, gan ražotājam. Reģistrācijas apliecības īpašnieks izmeklē trauksmes brīdinājumu, veicot šādas darbības un pārbaudot:
• vai nav datu augšupielādes kļūdas?
• vai nav kļūda EU hub?
• sazinās ar Latvijas Zāļu verifikācijas organizāciju par iespējamiem cēloņiem;
• pieprasa iepakojuma attēlu no gala lietotāja;
• īpašos gadījumos var pieprasīt iepakojumu no gala lietotāja.
Ja tiek atrasts trauksmes brīdinājuma cēlonis, jāveic attiecīgi korektīvie pasākumi, piemēram, jānovērš datu ievades kļūda, kā arī jāinformē gala lietotājs un Latvijas Zāļu verifikācijas organizācija.
Kurus trauksmes brīdinājumus reģistrācijas apliecības īpašnieks var neizmeklēt?
Saskaņā ar Eiropas Zāļu verifikācijas organizācijas vadlīnijām “Labās prakses piemēri rīcībā ar trauksmes brīdinājumiem”, reģistrācijas apliecības īpašniekam (RAĪ) nav jāizmeklē “A7”, “A24” un “A68” trauksmes brīdinājumi, izņemot tālāk norādītos gadījumus, kad:
• RAĪ apzinās, ka trauksmes brīdinājumu ir izraisījis pats, veicot atkārtotu darbību iepakojumam, kas ir viņa kontrolē;
• gala lietotājs sazinās ar RAĪ par konkrēto trauksmes brīdinājumu;
• nacionālā zāļu verifikācijas organizācija sazinās ar RAĪ par konkrēto trauksmes brīdinājumu, piemēram, “A7”, “A24” vai “A68” trauksmes brīdinājuma gadījumā, ko ģenerējis gala lietotājs, kas nevar noteikt trauksmes brīdinājuma cēloni;
• valsts kompetentās iestādes pieprasa izmeklēt konkrēto trauksmes brīdinājumu.
Šādas pieejas iemesls ir tas, ka “A7” un “A24” trauksmes brīdinājumi, ko ģenerējuši gala lietotāji, reti ir radušies RAĪ kļūdu dēļ. Tāpat lielākā daļa “A68” trauksmes brīdinājumu, ko ģenerē gala lietotāji, ir saistīti ar gala lietotāja programmatūras vai skenera problēmām.
Cik ilgā laikā reģistrācijas apliecības īpašniekam ir jāsniedz atbilde gala lietotājam?
Reģistrācijas apliecības īpašniekam ir jāsniedz atbilde gala lietotājam par konkrēto trauksmes brīdinājumu 2 darba dienu laikā.
Par reģistrācijas apliecības īpašnieku pienākumiem
Kādi ir galvenie pienākumi?
Reģistrācijas apliecības īpašniekiem ir:
• jānodrošina, ka visi iepakojumi, kas laisti tirdzniecībā Eiropas, tai skaitā Latvijas, tirgū pēc 2019. gada 9. februāra, satur drošības pazīmes: unikālos identifikatorus un iesaiņojuma neskartības pazīmes;
• jāpievienojas ES centrālajai datubāzei (EU hub), kuru pārvalda Eiropas Zāļu verifikācijas organizācija;
• jāaugšupielādē zāļu iepakojumu dati EU hub;
• jānoslēdz sadarbības līgums ar Latvijas Zāļu verifikācijas organizāciju;
• jāveic regulāri maksājumi zāļu verifikācijas sistēmas uzturēšanai;
• jāizmeklē trauksmes brīdinājumi;
• jāinformē Veselības inspekcija, ja ir aizdomas par viltotām zālēm.
Kad ir jāslēdz sadarbības līgums?
Reģistrācijas apliecības īpašniekam ir jāslēdz sadarbības līgums ar Latvijas Zāļu verifikācijas organizāciju, tiklīdz ir paredzēts izplatīt zāles Latvijas tirgū un/vai Latvijas zāļu verifikācijas sistēmā tiek augšupielādēti dati par produktu partijām un iepakojumiem.
Kas jādara, lai noslēgtu sadarbības līgumu?
Reģistrācijas apliecības īpašniekam (RAĪ) ir jāsazinās ar Latvijas Zāļu verifikācijas organizāciju un jāiesniedz pamata informācija līguma noslēgšanai, nosūtot to uz e-pastu info@lzvo.lv:
• līguma slēdzēja nosaukums;
• līguma slēdzēja reģistrācijas numurs;
• 1 kontaktpersonas vārds, uzvārds; e-pasts; amats; tālruņa numurs;
• RAĪ pilnais nosaukums;
• 1 kontaktpersonas e-pasts un tālruņa numurs trauksmes brīdinājumu izmeklēšanai katram RAĪ.
Kā notiek sadarbības līguma slēgšana?
Sadarbības līgums starp Latvijas Zāļu verifikācijas organizāciju (LZVO) un reģistrācijas apliecības īpašnieku ir izveidots, ņemot vērā Viltoto zāļu direktīvas un Deleģētās Regulas prasības par Latvijas zāļu verifikācijas sistēmas (LZVS) izmaksu un visu pārējo ar LZVS uzturēšanu un darbību saistīto izdevumu līdzfinansēšanu. Standarta līgums ir apstiprināts LZVO biedru sapulcē. Tas nav apspriežams. Pēc līguma rekvizītu saskaņošanas, abu pušu paraksttiesīgās personas to paraksta fiziski vai ar drošu elektronisko parakstu.
Kāda ir dalības maksa?
Latvijas Zāļu verifikācijas organizācija (LZVO) ir atbildīga par Latvijas zāļu verifikācijas sistēmas izstrādi, īstenošanu, darbību un uzturēšanu. Reģistrācijas apliecības īpašnieks (RAĪ) vai tā pārstāvis apņemas finansēt savu daļu no ar LZVO saistītajām izmaksām saskaņā ar Līguma noteikumiem.
Līgums paredz divu veidu maksas: vienreizējā reģistrācijas maksa un ikgadējā fiksētā gada maksa. Fiksētās gada maksas apjoms ir mainīgs, tās lielumu apstiprina LZVO biedru sapulce, un LZVO par fiksētās gada maksas apmēru nākamajam gadam informē visus RAĪ ne vēlāk kā līdz iepriekšējā gada 30. novembrim.
Par rīcību, ja ir aizdomas par viltotām zālēm
Kas ir viltotas zāles?
Viltotas zāles – jebkuras zāles ar falsificētu:
• identitāti (iepakojums, marķējums, nosaukums, sastāvs, stiprums),
• avotu (ražotājs, ražotājvalsts, izcelsmes valsts, reģistrācijas īpašnieks),
• vēsturi (ražošanas dokumenti un dokumenti, kas attiecas uz izmantotajiem izplatīšanas tīkliem).
Kad ir jāinformē kompetentās iestādes?
Nekavējoties, fakta atklāšanas dienā, zāļu vairumtirgotājam, aptiekas vadītājam vai zāļu reģistrācijas īpašniekam ir jāpaziņo Veselības inspekcijai, ja ir aizdomas par iespējami viltotām zālēm.
Kāda informācija ir jānorāda paziņojumā?
Atbilstoši Ministru kabineta noteikumu Nr. 416 “Zāļu izplatīšanas un kvalitātes kontroles kārtība” 116. pantam, paziņojumā Veselības inspekcijai norāda:
• zāļu nosaukumu, stiprumu vai koncentrāciju un zāļu formu;
• zāļu marķējumā un lietošanas instrukcijā norādīto ražotāju un reģistrācijas īpašnieku (ja tāds ir);
• zāļu sērijas numuru;
• personu, no kuras zāles iegādātas;
• citu informāciju, kas palīdz izmeklēt iespējamo viltošanas gadījumu (piemēram, trauksmes brīdinājuma numuru).
Kam ir jāziņo par iespējami viltotām zālēm?
Ja ir aizdomas par iespējami viltotām zālēm un iespējami nekvalitatīvām zālēm, Ministru kabineta noteikumu Nr. 416 “Zāļu izplatīšanas un kvalitātes kontroles kārtība” 11. un 13. punktā minētās personas, komersants vai saimnieciskās darbības veicējs, kuram izsniegta speciāla atļauja (licence) aptiekas atvēršanai (darbībai), ārstniecības iestādes, sociālās aprūpes institūcijas, praktizējoši veterinārārsti, veterinārmedicīniskās aprūpes iestādes vai citas personas par tām nekavējoties, fakta atklāšanas dienā, paziņo zāļu reģistrācijas īpašniekam un Veselības inspekcijai.
Ja Veselības inspekcijai, saņemot paziņojumu, rodas aizdomas par zāļu vai izejvielu viltojumu, Veselības inspekcija informē tiesībaizsardzības institūcijas.
Kā uzglabāt potenciāli viltotas zāles?
Viltotas zāles, kuras ir atklātas izplatīšanas tīklā, uzglabā atsevišķi no citām zālēm, lai novērstu jebkuru sajaukšanas iespēju. Tām jābūt skaidri marķētām ar īpašu norādi – "nav paredzēts pārdošanai".
Par klientu portālu
Kas ir klientu portāls?
Latvijas Zāļu verifikācijas organizācija (LZVO) ir izveidojusi slēgtu klientu portālu, kuram ir divi moduļi un kas paredzēts tikai reģistrētiem lietotājiem – reģistrācijas apliecības īpašniekiem (RAĪ) un sistēmas gala lietotājiem.
Klientu portālā ir izveidots individuāls profils katram LZVO sadarbības partnerim jeb uzņēmumam, kā arī pieejama profesionāla informācija un ērta saziņa ar LZVO.
Kāda informācija pieejama klientu portālā?
Klientu portāla gala lietotāju sadaļā ir pieejama aktuālākā informācija par gala lietotāju, kas ir ļoti būtiska, lai nodrošinātu pieeju Latvijas zāļu verifikācijas sistēmai tikai leģitīmiem gala lietotājiem. Tādēļ gala lietotāju pienākums ir uzturēt aktuālus datus klientu portālā.
Klientu portāla sadaļā reģistrācijas apliecības īpašniekiem ir pieejama aktuālākā informācija par pārstāvētā reģistrācijas apliecības īpašnieka kontaktpersonām, kā arī par fiksētajām gada maksām, rēķiniem un citiem sadarbības jautājumiem.